Julien Robert-Paganin, ancien étudiant de L3 biologie d’Avignon, a reçu la médaille de bronze du CNRS pour ses travaux sur les moteurs moléculaires
Julien Robert-Paganin, ancien étudiant de la Licence Biologie d’Avignon Université, a reçu la Médaille de bronze du CNRS 2025. Aujourd’hui chargé de recherche au CNRS, au sein du laboratoire Biologie cellulaire et cancer de l’Institut Curie, il est distingué pour ses travaux en biologie structurale et biophysique.
Un parcours exemplaire
Après une licence en biologie générale à Avignon Université, Julien Robert-Paganin poursuit une thèse à l’Université Paris Descartes, puis rejoint en 2015 l’équipe Motilité Structurale d’Anne Houdusse à l’Institut Curie. C’est là qu’il découvre les myosines, protéines motrices indispensables à la contraction musculaire, à la division et à la migration cellulaires.
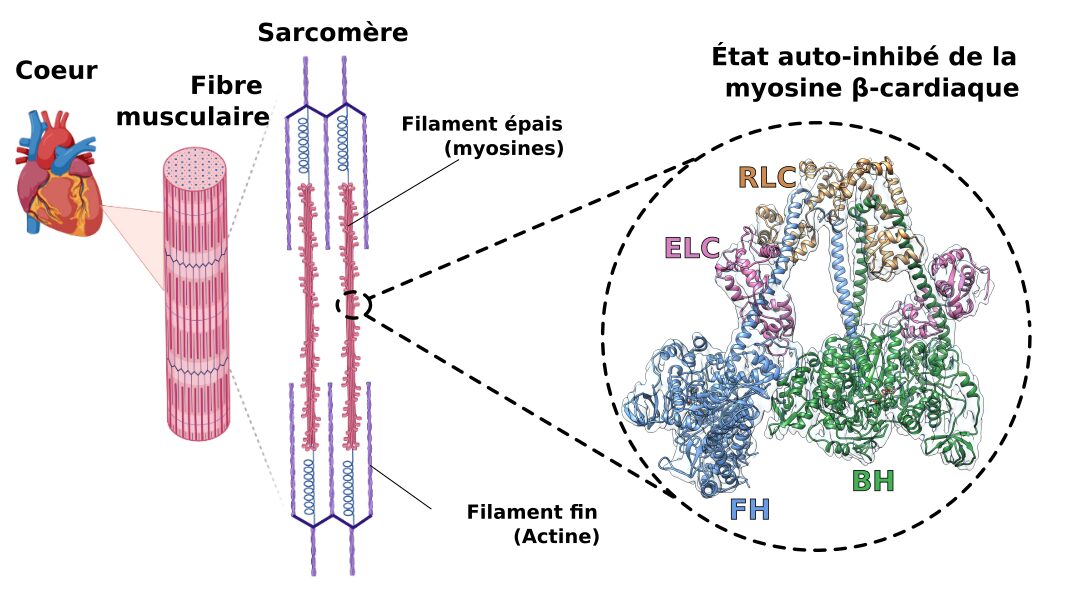
Recruté au CNRS en 2019, il s’attaque à un défi scientifique de taille : comprendre l’« état de repos » de la myosine cardiaque. Grâce à la cryo-microscopie électronique, il met en évidence un mécanisme jusque-là insoupçonné, ouvrant la voie à de nouvelles pistes thérapeutiques contre certaines maladies cardiaques héréditaires et le paludisme.

En quoi vos travaux sur les protéines cardiaques ont contribué à mieux comprendre les maladies cardiaques ?
Mes travaux portaient initialement sur la régulation de la myosine cardiaque. Si le cycle de production de force était connu depuis des années, cette myosine présente aussi un état « de repos » inactif, central dans sa régulation mais bien moins caractérisé. Cet état inactif est notamment lié à des maladies cardiaques très répandues : les cardiomyopathies hypertrophiques (HCM).
Nous avons résolu la structure de l’état de repos de la myosine cardiaque à haute-résolution par cryo-microscopie électronique. Cela permet d’une part de mieux comprendre la régulation de la myosine cardiaque et comment elle peut se mettre « au repos » pour réguler la force produite par le cœur durant son fonctionnement et d’autre part d’étudier l’effet des mutations responsables des cardiomyopathies hypertrophiques sur cet état « de repos » et comment elles peuvent altérer le fonctionnement du cœur.
En parallèle, nous avons également étudié et caractérisé la myosine A d’un des parasites responsables du paludisme, Plasmodium falciparum (PfMyoA). Nous avons démontré que cette myosine est nécessaire lors de l’infection et qu’elle a un mécanisme de production de force très différent des autres myosines connues. Ces travaux démontrent que PfMyoA est une cible thérapeutique de premier ordre et qu’elle pourrait être ciblée dans de nouvelles approches antipaludiques.
Voir la publication du 30/06/2023 :
https://curie.fr/actualite/publication/myosine-cardiaque-au-repos-sa-structure-enfin-revelee
Qu’est-ce qui fait l’originalité de ces travaux dans le contexte scientifique actuel ?
Actuellement, les deux myosines que j’ai étudiées sont liées à des maladies communes et graves : (i) les HCM sont parmi les maladies héréditaires les plus fréquentes et touchent un individu sur 500, (ii) le paludisme a causé plus de 600 000 décès en 2023. Il faut ajouter à cela qu’il est urgent de trouver de nouveaux traitements pour ces maladies. Nos travaux permettent d’ouvrir la voie pour de nouvelles stratégies thérapeutiques avec des petites molécules capables de moduler la force produite par les myosines. L’objectif final est de fournir les outils qui permettront à l’avenir de développer des approches de médecine personnalisées. Grâce aux approches de biophysique et biologie structurales, nous avons pu participer à la caractérisation (i) de Mavacamten, un inhibiteur de la myosine cardiaque aujourd’hui commercialisé pour traiter des HCM et (ii) de KNX-002, un inhibiteur spécifique de PfMyoA.
L’originalité méthodologique de ces travaux réside dans le couplage de plusieurs échelles et de plusieurs approches. Nous étudions les moteurs moléculaires à l’échelle atomique, mais nous collaborons avec des équipes internationales qui font des études d’activité de ces protéines ou utilisent des approches de biologie cellulaire. Nous défendons une approche pluridisciplinaire et collective.
Quels sont vos nouveaux axes de recherche et leur originalité ?
À l’avenir, je souhaite concentrer mes recherches sur l’actine de Plasmodium, une protéine également impliquée dans la production de force et qui interagit avec les myosines. L’objectif sera là-aussi de comprendre précisément comment l’action de cette protéine est régulée chez le parasite et de contribuer au développement de molécules thérapeutiques qui ciblent non seulement les myosines, mais également l’actine de Plasmodium falciparum afin de bloquer plusieurs acteurs impliqués dans l’infection.
En quoi votre formation initiale en licence de biologie à Avignon a été importante pour vous ?
Mon passage à l’université d’Avignon en licence m’a permis d’avoir une formation solide et plutôt générale car la licence couvrait un grand nombre de sujets. Cela m’a ouvert aux approches pluridisciplinaires et m’a permis d’explorer différents aspects de la science, aiguisant ma curiosité. Cela a confirmé ma vocation et mon désir faire de la recherche. J’ai également eu la chance d’effectuer plusieurs stages volontaires dans des équipes de recherche, ce qui m’a permis de voir comment les choses fonctionnent au quotidien dans un laboratoire.
En 2026, Avignon Université aura le plaisir de recevoir Julien Robert-Paganin pour une conférence. Elle sera annoncée sur le site de l’université.
Voir les articles :
Le Dr Julien Robert-Paganin décroche la médaille de bronze du CNRS 2025
Julien Robert-Paganin, décodeur des moteurs de la vie – CNRS Biologie
Mis à jour le 23 septembre 2025